2022年11月18日,我院杨帆课题组在Nature Communications上发表题为A redox switch regulates the assembly and anti-CRISPR activity of AcrIIC1的研究成果。该研究首次发现NmeAcrIIC1存在由两个保守半胱氨酸介导的氧化还原开关,该开关通过调节AcrIIC1单体-二聚体的氧化还原循环,来动态调控其对Cas9的抑制活性。基于新发现,研究人员进一步设计并获得在高活性氧细胞环境内具有高效抑制Cas9活性的AcrIIC1突变体蛋白,为降低CRISPR基因编辑脱靶效应的分子设计提供了新思路。
Anti-CRISPRs(Acrs)是噬菌体作为抗击细菌CRISPR系统自卫机制进化而来的一类重要调控蛋白,通常由80-150个氨基酸组成。其可通过抑制靶DNA结合或切割,使CRISPR系统失活。Acrs是CRISPR-Cas系统的天然抑制剂,更是潜在的降低CRISPR基因编辑技术脱靶效应的强有力分子工具。然而,目前对于细胞内Acrs抑制CRISPR的这个重要生物过程动态调控的研究还相对比较薄弱。
作者首先通过结构和序列分析预测,脑膜炎双球菌(Neisseria meningitidis,Nme)物种的AcrIIC1蛋白中可能存在氧化还原开关。进一步,运用液态NMR、SEC、BLI、DNA cleavage等实验,证明该开关真实存在并能够调节AcrIIC1单体-二聚体的相互转化和对Cas9的抑制活性(图1左)。虽然早在2017年,Doudna课题组就解析了NmeAcrIIC1与HNH复合物的结构,后续也有许多关于NmeAcrIIC1的研究,但是因为实验过程中都使用了TCEP、DTT等还原剂,抑制了氧化态蛋白的形成。作者运用液体NMR和X-ray方法分别解析了还原态和氧化态NmeAcrIIC1的结构,发现在氧化状态下,两个AcrIIC1分子通过原本暴露在溶剂中的第17和80号半胱氨酸实现分子间“手拉手“键连,以旋转对称的方式形成了二聚体的构象。而二聚体的界面,正好与AcrIIC1识别Cas9复合物中的核酸酶结构域HNH的界面高度重合,从空间位阻的角度解释了氧化态AcrIIC1失活的分子机制。
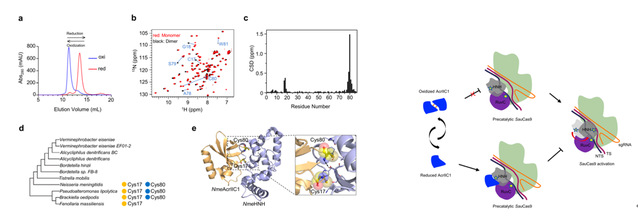
图1左:氧化还原开关的预测与初步鉴定;图1右:AcrIIC1不同氧化还原状态如何影响Cas9活性的模式图。
进一步,作者在体外通过氧化剂和还原剂诱导了AcrIIC1的氧化还原循环,并通过NMR测定半胱氨酸pKa的方法推测了两个半胱氨酸介导氧化还原过程的分子机理。有趣的是,通过系统发育分析和生化实验验证,证实这两个半胱氨酸介导的氧化还原开关也存在于Brackiella oedipodis (Boe)和Pseudoalteromonas lipolytica (Pli)两个物种中。这一发现揭示了氧化还原调控很可能是Acrs普遍存在的一种调控机制。图1右为作者提出的一个模型,展示AcrIIC1不同氧化还原状态如何通过影响Cas9亚基之间的相互作用,从而调控其活性的动态过程。
在发现AcrIIC1受氧化还原环境调控的新机制后,作者进一步基于结构设计寻找在不同体内环境都具有高活性的AcrIIC1分子。通过设计筛选成功获得了AcrIIC1-SS突变体,其不受氧化还原调控的同时,保持了野生型AcrIIC1的抑制活性。体外的NMR、SEC、BLI、DNA cleavage实验验证了该突变体在各种氧化还原条件下始终保持稳定的、与还原态相当的抑制CRISPR-Cas9的活性(图2)。更为重要的是,作者还利用抗菌敏感性实验,在大肠杆菌体内对比了突变体与野生型的抑制活性,证实了在双氧水应激下的细胞内环境,野生型完全失去了活性,而突变体依然可以有效抑制CRISPR-Cas9。

图2:不同的氧化还原条件下,wtAcrIIC1与AcrIIC1-SS抑制CRISPR-Cas9的活性比较及示意图。
为什么噬菌体能够进化出如此精巧的氧化还原调控机制呢?作者在文中提出了一个可能的解释:AcrIIC1的氧化失活机制,可能是噬菌体在其宿主细菌经历氧化应激时,通过CRISPR-Cas系统帮助宿主防御其他更致命的压力,从而保护自己,实现与宿主的双赢。AcrIIC1作为一个广谱的CRIPSR-Cas9抑制剂,一个重要的抑制CRISPR脱靶效应的工具蛋白,存在一个氧化还原开关。这项研究成果给我们两重启示:在细胞内,尤其在肿瘤细胞等高活性氧环境下应用Acr,要考虑细胞内局部的氧化环境使Acr失活的可能性;利用Acr的氧化还原开关,可以实现对Cas9蛋白的更加动态及精细的调控。本工作对氧化还原依赖性Acr的发现以及设计为有效降低CRISPR基因编辑脱靶效应提供了新的设计思路。
该研究获得国家自然科学基金委,哈工大国际合作部世界顶尖大学战略合作项目经费的支持,获得国家蛋白质科学研究(上海)设施核磁系统和北京国家蛋白质科学基础设施-北京大学分设施核磁平台的支持。杨帆课题组赵雅楠、上海有机所胡姣姣、哈工大环境学院杨珊珊副研究员为本论文的共同第一作者,哈工大毕业生仲憬(现在西湖大学攻读博士研究生)为本研究中数个关键实验数据的采集做出了重要贡献,杨帆副研究员为文章的通讯作者。哈工大黄志伟教授,上海有机所张胜男副研究员、刘建平副研究员,及上海科技大学季泉江研究员为本研究提供了大力支持。
原文链接:https://www.nature.com/articles/s41467-022-34551-8

