2022年11月15日,胡颖教授研究团队在未折叠蛋白反应(UPR)介导的肿瘤细胞适应期向死亡期转换调控肿瘤耐药的分子机制研究中取得了重要进展。相关内容以研究论文的形式发表于《细胞死亡与分化》(Cell Death and Differentiation)(IF=12.067),论文题目为《抑制iASPP调控终末期UPR提高结直肠癌对BRAF抑制剂的敏感性》(iASPP suppression mediates terminal UPR and improves BRAF-inhibitor sensitivity of colon cancers)。
肿瘤耐药是导致肿瘤患者治疗效果不佳的重要原因,由于其机制复杂,目前,直接通过靶向肿瘤耐药治疗肿瘤的效果并不理想,因此,明确肿瘤耐药的分子机制将为治疗肿瘤提供重要靶点。
肿瘤细胞的基因突变、钙稳态失衡以及来自肿瘤微环境的低氧,氧化还原稳态失衡等多种生物学改变均可导致内质网中错误折叠蛋白的累积,从而破坏内质网稳态,导致内质网应激。在此应激压力作用下,肿瘤细胞可启动未折叠蛋白反应(Unfolded Protein Response,UPR);UPR作为肿瘤细胞最为重要的适应系统之一,可通过整合多条信号转导途径来适应外界刺激,缓解内质网应激,恢复内质网稳态,促进肿瘤细胞存活。然而,当内质网应激不能得到缓解,内质网稳态无法恢复时,UPR则转而激活细胞凋亡通路,导致细胞死亡。部分化疗药物可通过诱导不可缓解的内质网应激,诱导细胞死亡,进而发挥肿瘤抑制效应;而UPR适应性通路的激活则会导致肿瘤耐药和恶性增殖。GRP78作为UPR的重要调控因子,在内质网应激发生时,通过激活下游级联信号反应,或缓解压力促进存活,或激活凋亡通路促进细胞死亡。可见,UPR介导的细胞死亡机制虽然具有潜在临床应用价值;但是,如何促进适应性生存向死亡的信号转换,却是尚未完全阐明的重要科学问题。
胡颖教授团队通过生物信息学分析并结合实验发现,癌基因iASPP差异表达与内质网应激的发生相关,进一步通过肿瘤细胞模型和裸鼠成瘤模型研究发现,在内质网应激诱导的肿瘤细胞从适应到死亡的转变过程中,iASPP表达降低。同时发现,过表达iASPP能够成功抑制内质网应激诱导的细胞死亡。提示iASPP作为内质网应激诱导的UPR介导的适应性生存向死亡转换过程中重要的“分子开关”。进一步分子机制研究发现,向死亡的转变过程中,iASPP表达降低是由于RNA结合蛋白Hu-antigen R (HuR)调控;低表达的iASPP与UPR的关键调控因子GRP78竞争性结合E3连接酶RNF185的能力降低,促进RNF185与GRP78结合,进而降低GRP78表达,激活下游的促凋亡通路,促进肿瘤细胞死亡。团队基于该机制,发现通过HuR抑制剂或特异性抑制iASPP可有效抑制GRP78表达,导致UPR介导的适应期到死亡期的转变,进而达到抑制肿瘤生长及提高化疗敏感性的作用。研究明确了iASPP/GRP78敲低调控终末期UPR,促进内质网应激诱导的细胞凋亡并抑制肿瘤生长,提高化疗药物敏感性的新机制,为靶向终末期UPR调控肿瘤耐药提供重要的分子靶点(图一)。
该研究得到自然基金委项目经费支持,生命学院胡颖教授,哈尔滨医科大学肿瘤医院李栗医生为共同通讯作者,郑善亮助理教授和王星文副研究员为该文章的第一作者。生命学院博士生刘皓,林庆宇参与其中。该研究获得哈尔滨医科大学肿瘤医院李栗医生的大力支持。
原文链接:https://www.nature.com/articles/s41418-022-01086-w
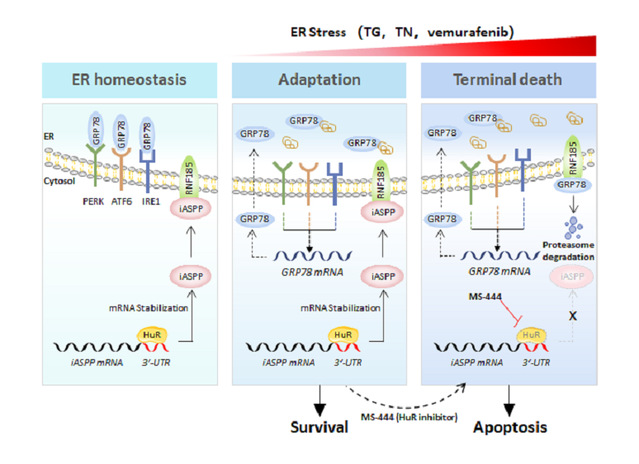
图一:iASPP/GRP78调控终末期UPR影响内质网应激诱导的细胞凋亡示意图

