8月28日,生命学院黄志伟课题组在《自然》(Nature)上在线发表了题为《人T细胞受体-共受体复合物组装的结构基础》(Structural basis of assembly of the human TCR-CD3 complex)的研究文章(Article)。该研究首次解析了人T细胞受体-共受体(TCR-CD3)复合物(包含全部8个亚基)的高分辨率冷冻电镜结构,通过对结构分析,揭示了TCR和CD3亚基在膜外侧以及膜内识别、组装成功能复合物的分子机制,从而回答了免疫领域关于T细胞受体结构的基础科学问题,而且对解析T细胞活化的分子机制具有重要的科学意义,同时也为开发基于T细胞受体的免疫疗法提供关键结构基础。
T细胞是脊椎动物适应性免疫系统的关键细胞,在病毒感染、癌症以及自体免疫疾病中起着关键作用。T细胞免疫反应包括由TCR首先识别抗原呈递细胞(APC)上结合了抗原肽的MHC复合物(pMHC),然后TCR通过其结合的共受体(CD3)将抗原信号传递到CD3的ζ亚基的胞内ITAM区域,进而启动T细胞内级联免疫信号通路杀死病原感染细胞或肿瘤细胞。
大多数成熟T细胞(约95%)的TCR由通过二硫键相连的α和β两条异二聚体肽链组成,TCRα/β的可变区(Vα和Vβ)负责识别抗原信号,TCRα/β与含有γ/ε、δ/ε’和ζ/ζ’六个亚基进行信号传递的共受体CD3组成TCR-CD3受体复合物,该复合物决定着T细胞的发育、激活以及对病原的免疫反应。在过去的二十年中,人们对TCR胞外可变区如何识别各种抗原进行了很深入的研究,但作为细胞免疫基础科学问题之一的TCR-CD3复合物组装以及信号转导的结构基础仍然未知。
本研究中首先对不同人的细胞库进行筛选确定研究的目标TCR复合物,接着寻找到合适的化学交联剂用于纯化蛋白复合物样品,接着通过冷冻电镜解析了第一个来源于人的TCRα/β-CD3复合物的3.7 Å的高分辨率结构(图一)。该TCR-CD3复合物结构包含完整的胞外结构域(ECD)以及所有跨膜区域。该TCR-CD3复合物结构显示其由1:1:1:1的TCRα/β:CD3γ/ε:CD3δ/ε’:CD3ζ/ζ’八聚体亚基组装形成,这与之前的生化研究结果一致。TCR-CD3复合物的胞外区域由TCRα/β的恒定区以及连接胞外和膜内的连接肽结合CD3的γ/ε和δ/ε’两个二聚体模块组装而成,TCR-CD3复合物胞外区域的组装在接近细胞膜的外侧形成类三次对称的结构,TCRβ亚基的恒定区位于该三次对称结构的中心位置。CD3膜内部分由ζ/ζ’亚基的两个跨膜螺旋和γ/ε以及δ/ε’亚基的跨膜螺旋结合形成桶状构象。TCR-CD3复合物膜内组装由TCRα/β的两个跨膜螺旋通过疏水和电荷作用插入CD3筒状跨膜结构中形成(图二)。所以,TCR-CD3各亚基近膜侧的连接肽以及膜内区域的强相互作用对整个复合物的组装起着关键作用。有趣的是,将该复合物结构与结合有pMHC的TCRα/β胞外的区域结构比较发现pMHC的结合并没有引起TCRα/β结构的明显变化。
文章审稿人对该项研究给予了高度评价:“该研究工作代表了细胞适应性免疫的分子机理研究的一个重要里程碑。通过阐明第一个在膜上组装的T细胞受体和其CD3共受体的结构,极大地增加了我们对T细胞识别抗原反应的激活机制的理解。”(“The work represents a major milestone in the study of the molecular basis of cell-mediated, adaptive immune responses. By elucidating the first structure of the membrane assembly between a clonotypic T cell receptor and its CD3 co-receptor, this work greatly enhances our understanding of the “triggering” mechanism which allows T cells to recognize and respond to aberrant peptide antigens.”)
生命学院博士生董德、硕士生林建铨以及北京大学博士生郑吕钦为该论文的并列第一作者。黄志伟教授和北京大学高宁教授为本研究论文的共同通讯作者。生命学院技术员张百灵、博士后朱玉威等参与该研究的部分工作。生命学院电镜平台以及北京大学冷冻电镜平台提供支持。本项目受到国家自然科学基金委、哈工大青年科学家工作室等基金的资助。
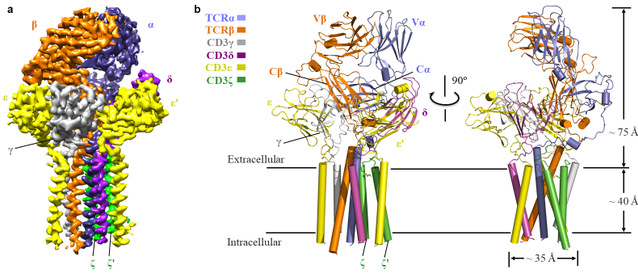
图一、TCR-CD3复合物的整体结构图
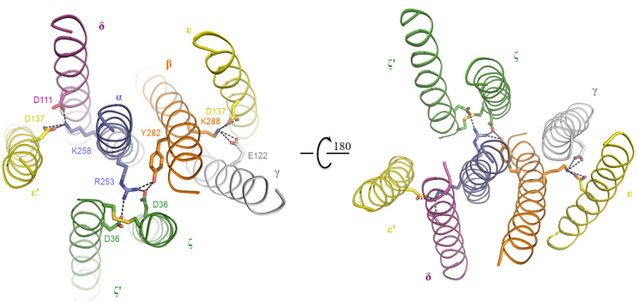
图二、TCR-CD3复合物细胞膜内组装的细节图
文章链接:https://www.nature.com/articles/s41586-019-1537-0

