近日,胡颖教授研究团队揭示了内质网应激(Endoplasmic Reticulum Stress, ER Stress)与DNA损伤应答(DNA Damage Response, DDR)系统之间的一种全新串扰机制, 该研究为癌症治疗提供了新的理论依据和潜在的联合靶向策略。相关内容以研究论文的形式发表于《美国科学院院报》(Proceedings of the National Academy of Sciencesof the United States of America)。
基因组不稳定性和蛋白稳态失衡是癌细胞的重要特点,在细胞内分别受DDR和ER Stress反应信号通路调控,对细胞命运具有重要调控作用。在包括癌症在内的许多人类疾病中,这两种信号通路经常处于共激活状态。研究发现,癌细胞中固有的基因组不稳定性或药物诱导的DNA损伤可增加内质网中的错误折叠蛋白,导致内质网应激。与此同时,内质网应激也可以促进活性氧(Reactive Oxygen Species, ROS)的产生,导致DNA损伤。尽管已有研究表明内质网应激反应中的未折叠蛋白反应(Unfolded Protein Response, UPR)和DDR之间存在密切关系和复杂的串扰,但内质网应激反应的另一重要途径——内质网相关蛋白质降解(ER-associated Protein Degradation, ERAD)与DDR之间的分子机制和调控关系尚不清楚。此外,在癌症的临床治疗中,无论是新兴的内质网应激激活剂还是经典的 DNA 损伤诱导剂都因耐药性而应用受限,揭示相关串扰机制也将为联合靶向内质网应激反应和 DNA 损伤应答,提高肿瘤的治疗效果奠定理论基础。
胡颖教授团队通过生物信息学分析发现,内质网应激与DNA损伤修复通路相关。进一步的实验结果表明,内质网应激诱导多种肿瘤细胞发生DNA损伤,并伴有DNA-PK-NHEJ DDR信号通路特异性激活,但在持续应激下,DNA-PK-NHEJ 则被抑制,后续研究发现DNA-PK-NHEJ信号的这种动态变化主要由KU70/KU80蛋白水平的改变所致。
通过进一步探讨持续内质网应激条件下KU70/KU80蛋白水平下降的分子机制发现,ERAD E3连接酶HRD1和TRIM25在其中发挥了关键作用。HRD1作为定位于内质网的ERAD连接酶,通过介导组蛋白去乙酰化酶HDAC1的泛素化修饰和蛋白酶体降解,阻断了HDAC1介导的KU70/KU80去乙酰化反应,提高了二者的乙酰化水平,从而增强了TRIM25对KU70/KU80的结合能力,进而促进TRIM25催化KU70/KU80泛素化修饰和蛋白降解。敲减HDAC1或应用HDAC/DNAPK抑制剂联合内质网应激诱导剂Celecoxib可以显著抑制肿瘤生长(图一)。该研究为深入理解ER Strss如何将应激信号传递至细胞核内,进而影响DDR提供了重要线索,并通过体外和体内肿瘤模型验证了这一机制的潜在靶向治疗意义。
该研究得到自然基金委项目经费支持,哈尔滨工业大学生命学院胡颖教授为通讯作者,向知渊博士为该文章的第一作者。华大基因侯桂雪博士及生命学院郑善亮助理教授参与其中。该研究获得哈尔滨医科大学肿瘤医院李栗医生和复旦大学基础医学院雷群英教授的大力支持。
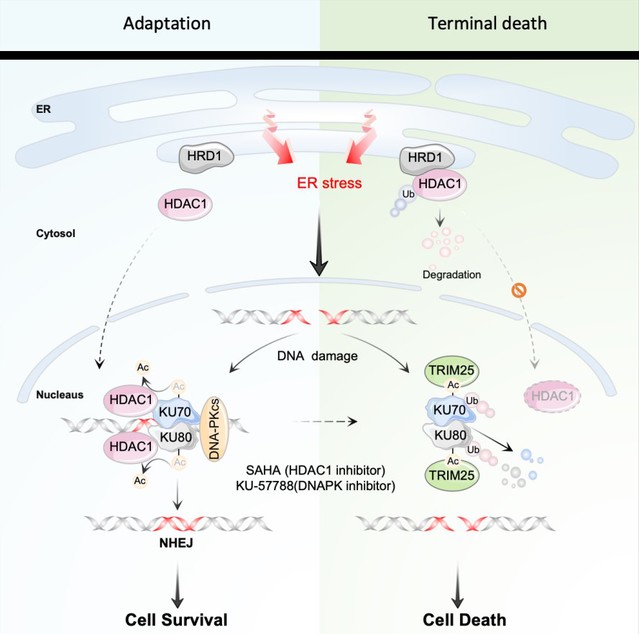
图一:ER Stress与DDR 串扰新机制:内质网相关降解连接酶 HRD1调节DNA-PKcs-NHEJ活性的分子机制

