4月4日,我院黄志伟教授团队在《细胞研究》(Cell Research)杂志在线发表题目为《C2c1-sgRNA复合物严谨型识别PAM序列的结构基础》(《Structural basis of stringent PAM recognition by CRISPR-C2c1 in complex with sgRNA》)的研究论文。
CRISPR-C2c1是一类V-B亚型的CRISPR系统,研究显示该系统能够在crRNA:tracrRNA的引导下剪切底物DNA,C2c1需要tracrRNA的引导才具备活性,这是与V-A型Cpf1系统只需要crRNA的引导完全不一样的;此外,C2c1和Cpf1识别的PAM序列也不一样。然而与Cpf1一样的是,C2c1也仅含有一个保守的RuvC核酸内切酶结构域。目前C2c1已经被证明能够在人类细胞裂解液中有剪切目的DNA的活性,但这背后的分子机制并不清楚。
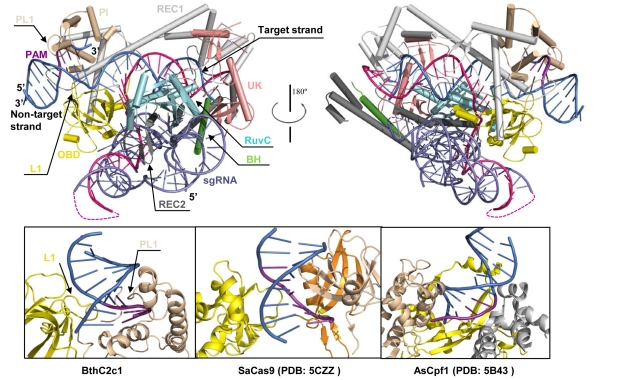
为了揭示C2c1识别crRNA和结合PAM的分子机制,该团队解析了Bacillus thermoamylovorans C2c1 (BthC2c1)和123-nt的crRNA(包含有几乎全长的crRNA以及tracrRNA),28-nt的target DNA,以及12-nt的non-target DNA的三元复合物的2.6 Å晶体结构。结构研究发现,与Cas9和Cpf1宽松型识别PAM序列不一样的是,BthC2c1通过一种严谨型方式识别PAM序列。而且通过分析结构,推测删除位于BthC2c1表面的sgRNA的Loop 1(38-nt)并不会影响BthC2c1引导剪切的活性,事实上,功能试验也证实上述推测。有趣的是,测序发现BthC2c1在target DNA上的剪切位点并不位于guide RNA:target DNA异源二聚体内,反映出和Cas9以及Cpf1不一样的剪切机制。因此,该复合物结构不仅揭示了C2c1结合sgRNA和识别PAM的分子机制,而且为改造C2c1以及其他Cas核酸内切酶,使之成为更高效、更特异的基因编辑工具提供了结构基础,具有指导改造新型基因编辑系统的应用价值。这是该课题组在病原与宿主相互作用系统以及基因编辑系统领域取得的又一研究成果。
黄志伟教授为本研究论文的通讯作者,该团队的博士研究生吴丹、关晓宇和师资博士后朱玉威为该论文的并列第一作者。上海同步辐射中心为晶体数据收集提供了及时有效的支持。本项目受到国家自然科学基金委、哈工大青年科学家工作室等基金的资助。
文章链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201746a.html

