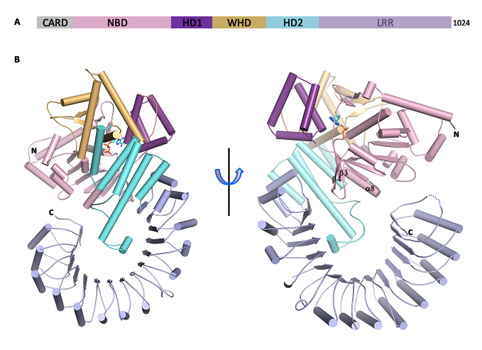
6月14日,国际顶级期刊《科学》(Science)在线发表我校生命学院黄志伟教授与清华大学柴继杰教授研究组等合作完成的题为《NLRC4蛋白自抑制机制的结构基础》(Crystal structure of NLRC4 reveals its autoinhibition mechanism)的研究论文,首次报道了小鼠NOD样受体NLRC4自抑制状态的晶体结构,并通过结构分析和生化实验揭示了该蛋白维持自抑制作用的分子机制,这也是NOD样受体家族中第一个被解析出的近乎全长的蛋白质晶体结构。我校生命学院黄志伟教授参与该项目的蛋白表达、纯化,行为表征等工作。
NOD样受体是2003年才发现的一类位于胞质内的模式识别受体,寡聚化后形成多蛋白复合物即炎症小体被激活,其自抑制机制、识别配体及激活的方式一直都是研究热点。NLRC4是NOD样受体家族中的一员,正常情况下处于自我抑制状态,病原菌进入细胞内时,NLRC4识别该病原菌,进而被激活,其激活过程伴随着NLRC4的自体寡聚化、炎症小体的形成、下游免疫应答反应等。该项研究揭示了小鼠NLRC4蛋白的晶体结构,分辨率为3.2Ǻ。该结构显示,ADP介导的核苷酸结合结构域(NBD)和同侧翼螺旋结构域(WHD)之间的相互作用对于稳定NLRC4的闭合构象起着至关重要的作用;同时研究发现螺旋结构域2(HD2)通过接触NBD中的一段保守且发挥重要功能的α螺旋而起着抑制作用;另外,C端的富亮氨酸重复结构域(LRR)的定位在空间上封闭了NBD结构域,从而使得NLRC4分子处于单体状态。当破坏ADP介导的NBD-WHD或NBD-HD2/NBD-LRR相互作用后,导致NLRC4组成型激活。
该研究通过结构生物学和生化实验揭示了NLRC4维持自抑制的机制,同时也是该家族中第一个被解析的近全长的蛋白晶体结构,该结构基础对于研究相关疾病发生的分子机理具有重要的意义。
黄志伟教授2012年从哈佛大学来校工作,主要从事蛋白质结构和功能研究工作。